▌ 导语:
据大通福克斯美国会诊中心(CMAA)了解:Alexion Pharmaceuticals公司今天宣布,FDA批准了Soliris (eculizumab) 用于治疗全身型重症肌无力 (gMG) 抗乙酰胆碱受体(AchR)抗体阳性的成人患者。关于最新相关的资讯信息,大通福克斯美国会诊中心(CMAA)将持续为您报道!

在3期临床试验REGAIN和正在进行的开放标签扩展研究中,Soliris对曾经历过免疫抑制治疗失败, 观察、行走、说话、吞咽和呼吸困难,以及可能需要住院和重症监护的患者,展现了治疗效果。
重症肌无力(MG)是一种衰弱、慢性、渐进的自身免疫性神经肌肉疾病,可以在任何年龄发生,但在40岁之前的女性和60岁以后的男性中最为常见。它通常从控制眼睛和眼睑运动的肌肉虚弱开始,通常会发展到更为严重和普遍的形式,称为gMG,显示为头部、颈部、躯干、四肢和呼吸系统的肌肉虚弱。
Soliris是一个同类首款(first-in-class)补体抑制剂。Soliris通过抑制终端补体来抑制免疫系统的失控性激活。作为孤儿药物用于治疗阵发性夜间血红蛋白尿(PNH),非典型溶血性尿毒症综合征(aHUS),和抗AchR抗体阳性gMG等罕见病。
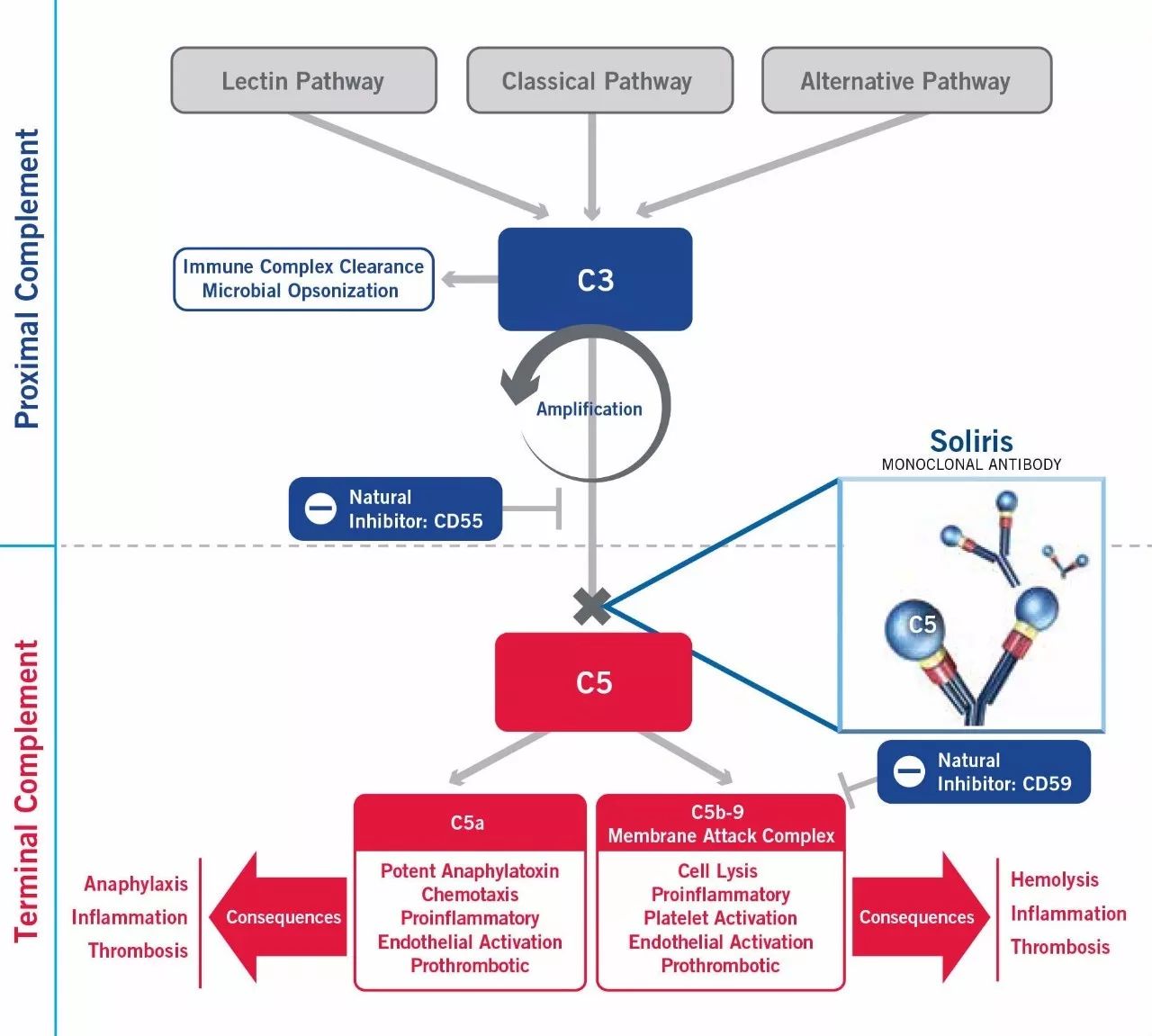
根据随机,双盲,安慰剂对照的3期多中心研究REGAIN(ECU-MG-301)的综合临床数据, FDA批准了Soliris的扩展适应症。REGAIN对125名难治性gMG患者进行了26周的有效性和安全性评估。这些患者均经确诊为MG,并有阳性抗AChR血清检测。94%(117 / 125)的患者完成了REGAIN研究后加入了开放标签扩展试验,其中56人继续接受Soliris(Soliris /Soliris 组),61人在完成重新研究后的两周内从安慰剂转换为Soliris(安慰剂/ Soliris组)。患者在扩展试验中,没有被告知先前的治疗。在此之后,所有患者每两周接受一个持续的开放标签治疗(每次1200毫克)。在49名Soliris/Soliris组和56名安慰剂/ Soliris组患者完成了26周的评估,每组有20名患者完成了52周的评估。这项研究仍在进行中,计划将持续到2019年1月。
REGAIN研究在主要终点(p = 0.0698)中以微弱的差距未达到统计学显著。然而,在22个预先指定的终点和分析中,有18个在四个评估中显示出p值< 0.05,支持早期、持续和实质性缓解。安全状况与过去10年Soliris在PNH和aHUS患者中的报告一致。中期扩展研究结果显示,在REGAIN研究中接受了26周Soliris治疗的患者,疗效又维持了52周(总计78周)。对于在REGAIN中服用安慰剂的患者,在扩展研究中使用Soliris治疗后,治疗效果在1 - 4周内显现,并在所有4个评估中持续52周。
“今天的批准对于Alexion来说是一个重要的里程碑。对于那些抗AchR抗体阳性的gMG患者来说,尽管现在已有治疗方案,他们仍承受着未解决的严重症状。” Alexion公司执行副总裁兼研发主管John Orloff博士说:“让我们感到自豪的是,我们可以利用对补体生物学的深刻理解,开发出Soliris来治疗这种使人衰弱的神经肌肉疾病。”
“我很高兴FDA认可了综合临床数据,支持使用Soliris治疗抗AchR抗体阳性gMG,” 北卡罗来纳大学教堂山分校(University of North Carolina, Chapel Hill)神经内科教授,该新适应症临床发展的首席研究员James Howard博士说:“令人兴奋的是,对接受现有疗法没有得到充分缓解的患者来说,现在将有一种新的治疗方案, 以改善患者的症状,使他们能够开展日常生活,并提高他们的生活质量。”
Soliris在欧盟被批准用于治疗抗AchR抗体阳性成年人顽固性gMG。Soliris在日本的新药申请已被日本厚生劳动省(MHLW)接受并审查。在美国,欧盟和日本,Soliris已经获得了治疗MG的孤儿药资格(ODD)。我们祝贺Soliris通过FDA扩展适应症批准,希望这款新药能为患有全身型重症肌无力患者们减轻痛苦,带来康复。
参考资料:
[1] Alexion Wins Expanded Approval for Blockbuster Drug Soliris
[2] FDA Approves Soliris® (Eculizumab) For The Treatment Of Patients With Generalized Myasthenia Gravis (GMG)
[3] Interim Analysis From Phase 3 Open-Label Extension Study Shows Sustained Benefits Of Soliris® (Eculizumab) Treatment For Patients With Refractory Generalized Myasthenia Gravis
大通福克斯美国会诊中心(CMAA)是一家专注于为中国患者提供美国高端精准医疗咨询和服务的专业机构。自成立至今,已经为许许多多的中国患者提供了这样的服务,不仅让他们体会到了高端的,专业的服务,而且接受了精准的,个体化的治疗。最重要的是,通过中心提供的服务,很多病人获得了满意的,甚至是超越他们期望的治疗效果。
▌ 推荐阅读:
9亿美元获PD-1单抗许可,Incyte开启新合作
银屑病新药获美国FDA批准,造福青少年患者
治疗黑色素瘤,诺华新药组合获突破性疗法认定



