▌ 导语:
今天,美国FDA加快批准了Lartruvo(olaratumab)与多柔比星(doxorubicin)联合治疗某些类型的成人软组织肉瘤(STS),适用人群为不能用放疗或手术治愈的STS患者,但他们可以接受经FDA批准的蒽环类化疗方案。Lartruvo由礼来公司生产上市。
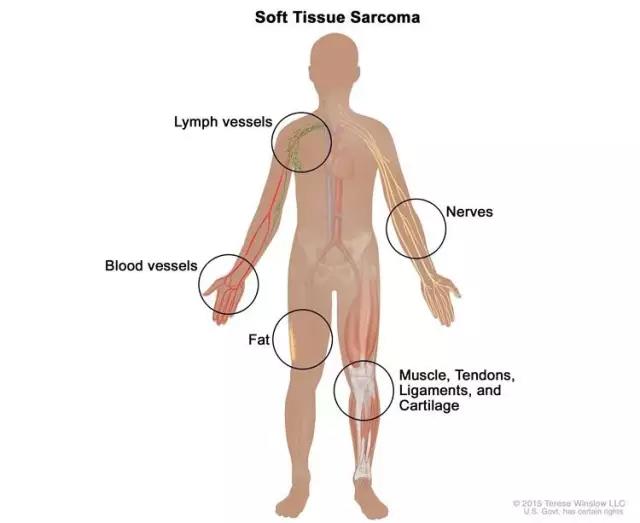
▲软组织肉瘤可病发于体内众多部位(图片来源:NIH)
据美国国家癌症研究所(The National Cancer Institute)估计,2016年将约有1.2万例STS新增病例以及近5千例死亡人数。经手术治疗后,针对STS的最常见的方案是接受多柔比星单药治疗或与其他药物联合治疗。STS能在人体内众多组织部位产生病灶,包括肌肉、脂肪、血管、神经、肌腱或关节内衬。
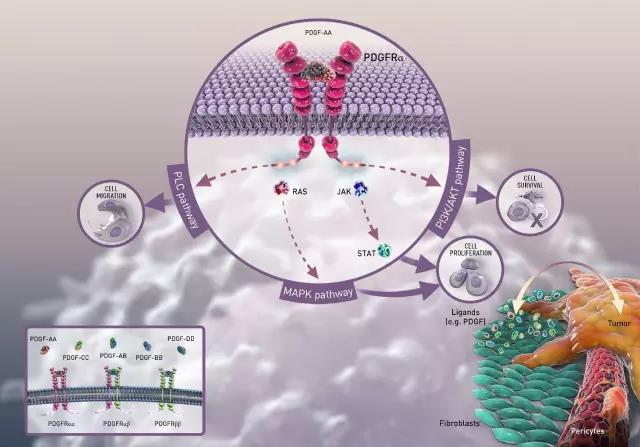
▲Lartruvo的作用机理(图片来源:Eli Lilly and Company)
Lartruvo是血小板衍生生长因子(PDGF)受体-α的阻截型抗体。当PDGF受体被相关配体刺激之后,下游信号通路可引起肿瘤生长。于是,Lartruvo通过阻断这些受体来有效减缓或终止肿瘤生长。
在一项涉及133人数、25多种不同亚型的转移性STS患者的随机临床试验中,Lartruvo的安全性和有效性得以评估,其中,患者接受Lartruvo加上多柔比星联合用药或多柔比星单一治疗。该试验测量了治疗后患者存活的时间长度(总生存率,OS),治疗后肿瘤无增长时间(无进展生存期, PFS)以及肿瘤收缩患者的百分比(总反应率,ORR)。接受多柔比星加上Lartruvo治疗的患者,他们的总生存率有统计学上的显著改善:中位生存期为26.5个月,而单独接受多柔比星的患者为14.7个月。接受Lartruvo+多柔比星的患者的中位无进展生存期为8.2个月,而单独接受多柔比星的患者为4.4个月。接受Lartruvo+多柔比星治疗患者的总反应率为18.2%,单独接受多柔比星的患者的总反应率只有7.5%。
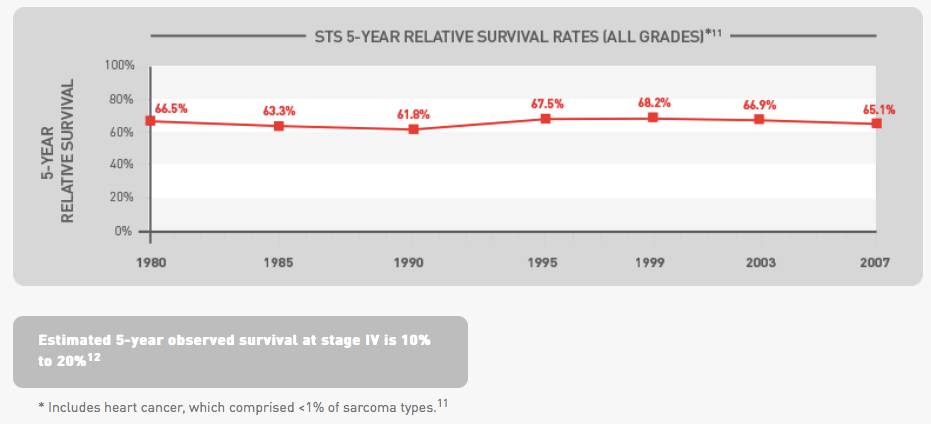
▲多年来现有治疗方案对患者的总生存率影响提高不大
(图片来源:Eli Lilly and Company)
FDA曾授予Lartruvo快速通道地位、突破性疗法认定和优先审查资格,Lartruvo也获得了孤儿药资格认定。目前一项更大的研究正在进行中,进一步探讨Lartruvo在STS多种亚型中的有效性。

▲FDA药物评价和研究中心血液和肿瘤产品办公室主任Richard Pazdur博士
参考资料:
[1] FDA grants accelerated approval to new treatment for advanced soft tissue sarcoma
[2] FDA官方网站
[3] Eli Lilly and Company官方网站



